日前,国际离子治疗联合会(PTCOG)乳腺癌小组委员会发布共识声明。评估了放射肿瘤学领域关于质子治疗乳腺癌的可用数据,提出了关于适应证和技术的专家共识建议,并强调了正在进行的临床试验的成本效益分析和未来研究的关键领域。第一期与大家分享了《乳腺癌质子治疗共识声明(一):理论基础—危及器官的剂量学优势》,本期为大家带来治疗计划的考虑:降低不确定性。原文发表于红皮杂志International Journal of Radiation Oncology Biology Physics上。

治疗计划考虑:降低不确定性
靶区
建议: 由于剂量梯度的陡峭性,精细、循证的CTV勾画在质子治疗计划中非常重要(LE 5, D级)。
由于质子布拉格峰剂量的急剧下降,所以精确的CTV勾画在质子治疗中非常重要。例如,尽管RTOG乳腺癌图谱不包括锁骨上窝后外侧(即后三角),但传统光子放疗锁骨上前斜方向射野可向该区域提供相当大的出射剂量。由于光子穿过组织时缓慢衰减,进入后三角的出射剂量通常能达到预期控制显微疾病处的剂量。研究表明,后三角区是锁骨上淋巴结转移的常见部位,约有一半的锁骨上淋巴结位于RTOG CTV的后方和横向边缘。因此,如RADCOMP试验图集(RTOG3510)所定义的,对于具有区域淋巴结放疗(RNI)适应证的患者,应考虑在该区域勾画更广泛的靶区。相反,食管旁和气管旁淋巴结是乳腺癌淋巴结转移的罕见部位。在临床无淋巴结累及的情况下,CTV内侧边界不应延伸至颈内静脉内侧,计划优化时应限制食管的剂量,以降低发生食管炎和继发性食管癌的风险。对于初始分期检查中肉眼可见的淋巴结肿大的病例,将PET图像或CT图像与CT模拟图像进行融合,以确保CTV包括高危淋巴结区域。对于胸壁CTV,在无直接临床侵犯的情况下,后边界不应延伸至肋间肌或肋骨,这样可使剂量在心脏和肺前迅速下降,并减少对肋骨的照射剂量(图2A~2C)。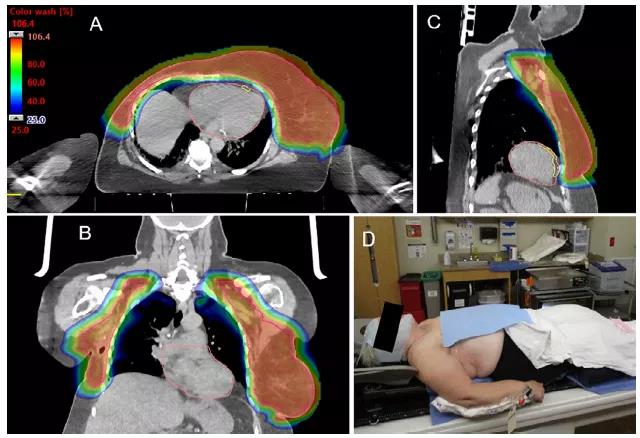
随着乳腺癌术后放疗(PMRT)靶区勾画指南的发展,与光子放疗相比,质子治疗可能会进一步减少对正常组织的照射剂量。例如,ESTRO最近修订了PMRT关于乳腺再造部分的靶区勾画共识指南。指南中,对于接受PMRT的患者,胸壁CTV仅限于植入物腹侧的皮下组织和胸大肌,在无“不利因素”的情况下排除植入物后的组织。若此种方法的安全性最终得到前瞻性确认,质子治疗将是将剂量递送至这些较小体积靶区的理想选择,从而进一步减少对心脏、肺和肋骨的照射。然而,胸大肌内和后侧复发的情况也已经被报道,可能是临床隐匿型。此外,这一区域在PMRT试验中已被常规治疗,即使CTV没有明确勾画,光子放疗计划中也至少部分覆盖了这一区域。最后,这种技术还没有被用于越来越普遍的胸前植入物重建的测试。因此,在现有数据的基础上,质子治疗中胸壁CTV应考虑纳入植入物最后方的范围和紧靠肋间肌和肋骨前的组织。
LET和RBE非均匀性
建议: 临床前和临床证据表明,用于肿瘤控制和毒性的质子RBE在射程末端会增加。在制定治疗计划时应注意这些潜在的影响(LE 4, C级)。
在临床实践中,常规使用固定的质子RBE值1.1;然而,RBE在布拉格峰和远端下降处要大于1.1,并且远端下降处质子束的LET值最大。典型的乳腺或胸壁RNI计划中,质子束远端边缘位于肋骨和肋间,邻近重要组织心脏和肺。当假定质子RBE转换的物理剂量不变时,较高的LET可导致更大的RBE。事实上,麻省总医院(MGH)的研究小组已经报告了晚期肺影像学改变及肋骨骨折方面的临床数据,显示RBE大于1.1。在Mayo Clinic,乳腺、胸壁和IMN CTV最后方的几毫米区域可以接受90%至95%的物理处方剂量,因为这些区域的LET较高,预计生物效应作用范围将扩大到这些区域。计划通常使用2~3个射野,以限制潜在的生物学热点和生物学效应范围扩展至肋骨、胸壁、心脏和肺。此外,为了降低因RBE不均匀性导致的晚期臂丛疾病风险,还需对臂丛进行剂量限制。质子治疗计划和递送方面的进展,如LET/RBE优化、可变RBE建模和点扫描质子弧形照射,可进一步缓解LET/RBE不均匀性对正常组织的潜在影响。
射程不确定性
对于所有的质子治疗计划,射程不确定性的潜在影响必须考虑,通常用质子入射射程的百分比来量化。典型乳腺CTV所需射程相对较浅,大多数乳腺治疗横贯的组织由脂肪、肌肉或腺组织组成,其射程计算的不确定性相对较低。因此,综合远端外扩约2~3 mm用于生成鲁棒性质子计划,使对心脏和肺精准保护成为可能。
自适应再计划
建议: 临床检查、体表成像和体积成像可识别影响剂量分布导致重新计划的解剖学变化(LE 4, C级)。
可靠的组织定位对于保证质子束路径长度的一致性至关重要。质子束的正面方向布野与有限的质子射程相结合,使沿胸壁界面的剂量分布对路径长度的变化非常敏感。例如,乳腺或胸壁的收缩(如血清瘤的消退)会减少质子路径的长度,从而增加对肺和心脏的剂量。相反,治疗引起的肿胀可在靶区最深处沿胸壁或IMN CTV形成一层欠量区。体表成像可识别治疗期间的解剖学变化,并已被用于治疗期间的跟踪。此外,可以考虑对治疗计划进行周期性的体积成像评估,以量化质子治疗过程中解剖学变化的影响。在组织变化导致计划鲁棒性破坏的情况下,可以考虑自适应计划。通过模拟潜在治疗期间的解剖学变化,使用鲁棒性治疗计划减少再计划的需要。因此,除患者特定因素,自适应再计划的需求可能随治疗机构使用的计划参数和原计划的鲁棒性而变化。在一项研究中,接受PMRT重建的患者有10%进行了再计划,以改善CTV靶区覆盖或/和均匀性。然而,在该机构进行乳腺癌部分乳腺加速照射(APBI)时,验证扫描的时间≤1%,由于治疗时发现与模拟相比无明显组织变化,因此验证扫描被放弃。
部分乳腺照射计划的考虑
APBI已实现俯卧位和仰卧位手臂上或下位摆位的可重复性。许多用于质子APBI治疗的初始技术包括使用固定扩展布拉格峰(SOBP)的3~4个射野、准直孔径和基于补偿器的双散射技术。根据乳腺内的靶区位置,使用这些技术时为了避免皮肤剂量重叠的情况必须在治疗野之间使用较大的角度间隔。这些更切向的射野可降低皮肤剂量,但可用低剂量治疗更大体积的乳腺组织,它们对准直误差和呼吸运动表现出更大的敏感性。
笔形束扫描(PBS)的实施为APBI提供了对质子束射野的点对点强度控制。这种增加的自由度可用于优化近端适形性,并且在射野存在重叠的情况下,也能提供皮肤剂量保护。此外,与双散射质子治疗相比,先进的束斑优化方法(如多野优化[MFO])可用于提高总体计划对摆位和射程不确定性的鲁棒性,并进一步减少危及器官剂量。
乳腺、胸壁和RNI计划考虑
为了避免周围正常组织的过量剂量,最常用的是正向射野;正向射野可远端保护心脏和肺及允许呼吸运动方向上的束流路径。在这种情况下,布拉格峰的远端剂量衰减被定位在肋骨、肋间隙和IMNs中,可充分利用质子束的远端剂量急剧衰减优势。区域淋巴,包括腋窝淋巴结和锁骨上淋巴结,也可用正向射野治疗。对于双散射质子治疗,处理区域的大小通常需要多个匹配射野和匹配线的变化。传统的皮肤表面匹配线的临床验证方法在典型的质子治疗递送系统中存在困难。PBS递送提供的束斑强度控制可使递送不需要准直器。PBS射野边缘设计成缓慢的梯度剂量衰减从而使其对摆位误差变得不敏感,这对治疗大的靶区尤其有利,如双侧乳腺癌(图2)。此外,PBS整个射野可做到像光子一样保护皮肤剂量(图3和图4)。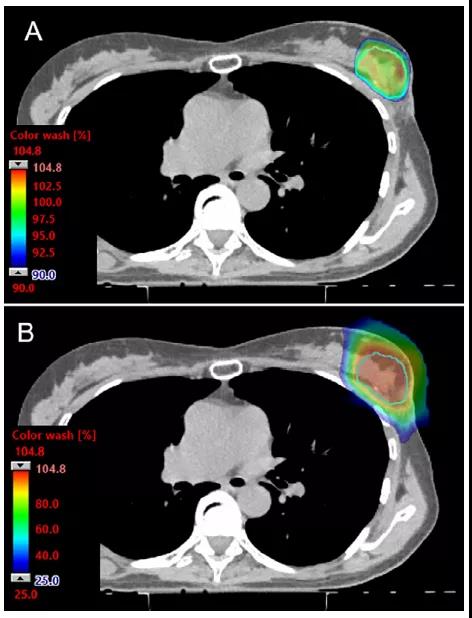
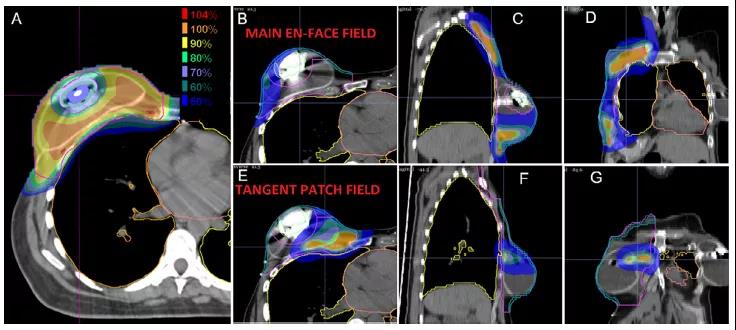
靶区剂量被优化给整个靶区提供均匀剂量(如单野均匀剂量)的计划中,最大程度的保护乳腺和胸壁区域的皮肤依赖于贯穿整个靶区的调制,因此想用更少的体表保护就需要大的调节。这种情况下,最大程度的皮肤保护将导致整个射野形成不均匀的分布。通过使用多个射野进行治疗,而且不要求每个射野的剂量均匀(即MFO),这些组合射野可一起优化,以实现更优的计划方案及更均匀的皮肤保护。鉴于乳腺癌质子治疗的显著差异,在评估和解释质子治疗结果时关注所使用的技术(即PBS与双散射)是至关重要的。
组织扩张器通常在乳腺切除术时放置,作为第二阶段乳腺重建的一部分。这些扩张器包含由高原子序数材料制成的金属端口,在CT计划图像上会产生相当大的伪影,提高了准确预测通过端口及其周围的阻止本领的复杂性。为应对这一挑战,减少金属伪影算法、围绕端口周围进行治疗的MFO技术(图4)、仔细的端口特征描述并使用蒙特卡罗方法来提高剂量计算的准确性的计划被实施,从而实现通过端口进行治疗。由此产生的质子计划比光子计划具有更加优越的剂量学特性。
深吸气屏气(DIBH)在光子计划中通过使心脏和冠状动脉远离束流以减少心脏剂量,目前已被证明是一种有效的方法。在一些乳腺癌质子治疗患者中,DIBH也可促使心脏结构向远离IMN CTV和高LET区域的下方和后方移动。然而,常规使用DIBH来减少未经筛选的患者的心脏剂量似乎并没有益处。DIBH过程造成的心脏物理位移通常被低密度肺组织所取代。由于乳腺癌质子治疗使用正向射野,它导致通往心脏的水当量路径长度变化极小,通常在无显著心脏位移的情况下,对心脏的额外保护很少。对于光子切线野,呼吸运动使靶区的深度边缘在高剂量区域内外振荡。质子递送中使用正向野,质子路径通常是呼吸运动的方向。虽然这些组织作为呼吸周期的一部分在移动,但从皮肤到靶区远端边缘的质子路径长度并不随呼吸运动而发生显著变化。因此,相对于束流射程和摆位的不确定性而言,典型的呼吸模式并不是治疗期间不确定性的主要来源,常规治疗计划过程中应对束流射程和摆位的不确定性加以考虑。