癌症免疫疗法通过利用免疫系统靶向并清除癌细胞,为肿瘤治疗带来了革命性变革。在各类免疫激活策略中,放疗因其能有效诱导免疫原性细胞死亡而备受关注。然而,放疗介导免疫原性细胞死亡所引发的抗肿瘤免疫应答经常受到肿瘤放疗抵抗和免疫抑制性肿瘤微环境的阻碍,其中肿瘤乏氧和细胞保护性自噬是尤为关键的影响因素。
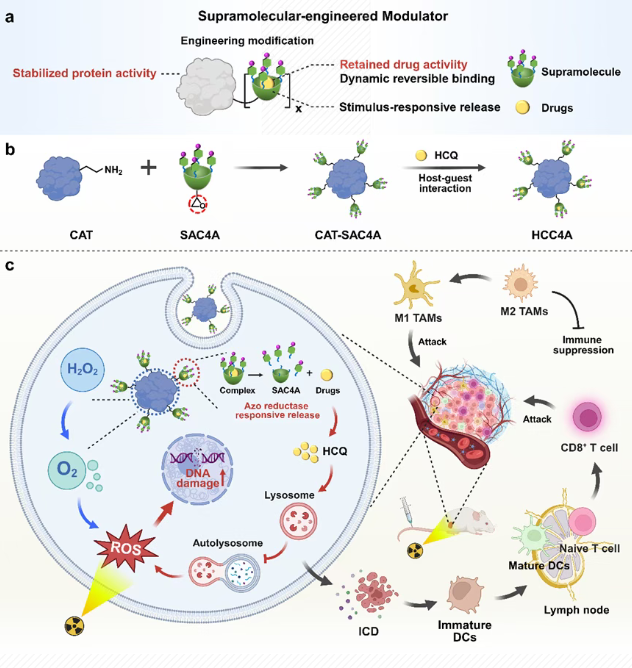
黄帆、刘鉴峰研究团队开发了一种超分子工程化免疫调节器(HCC4A),通过重编程肿瘤微环境增强抗体非依赖性的放射-免疫治疗。超分子工程化免疫调节器(HCC4A)以天然过氧化氢酶(CAT)为核心骨架,其表面通过环氧-胺偶联化学反应工程化修饰了多个超分子大环磺化偶氮杯芳烃(SAC4A),并利用主-客体相互作用将自噬抑制剂羟氯喹(HCQ)封装在SAC4A的空腔中。该策略能够将肿瘤内源性过氧化氢(H₂O₂)转化为氧气(O₂),从而缓解肿瘤的乏氧微环境,克服乏氧诱导的放疗抵抗。同时,在肿瘤过表达的偶氮还原酶催化作用下,工程化修饰的SAC4A可响应性释放HCQ破坏自噬过程,从而进一步重塑免疫抑制性肿瘤微环境,并放大放疗诱导的免疫原性细胞死亡效应。
实验结果表明,超分子工程化免疫调节器(HCC4A)通过激活强效的抗肿瘤免疫反应(包括促进树突状细胞成熟、细胞毒性T淋巴细胞浸润和M1型巨噬细胞复极化),显著增强了放疗对乳腺癌的治疗效果。因此,本研究提供了一种简便高效的超分子工程化策略,可实现对肿瘤微环境的有效调控和放射-免疫治疗疗效的大幅提升,在临床转化方面具有巨大潜力。