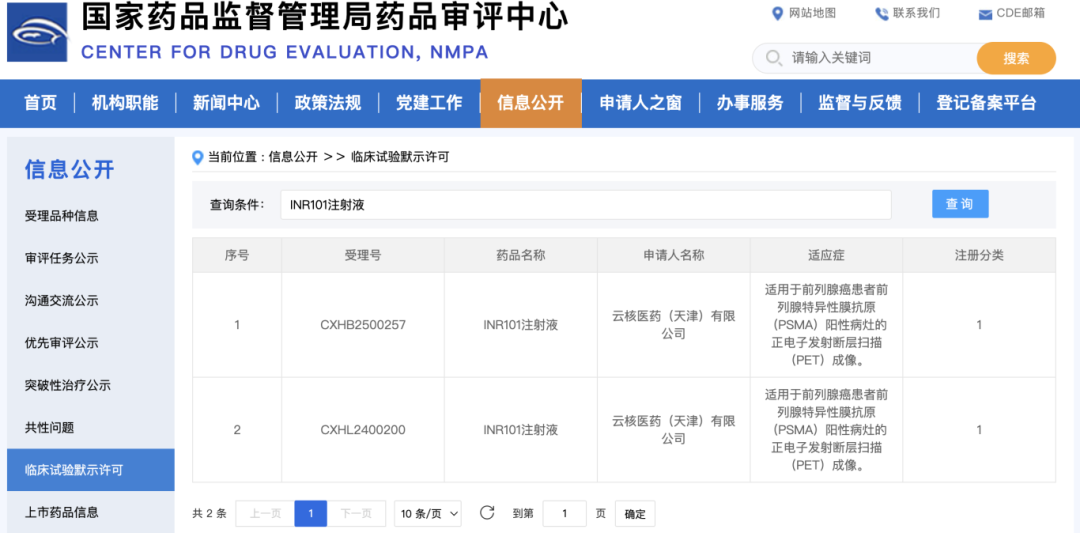
2025年11月28日,国家药品监督管理局药品审评中心(CDE)官网公示重大进展:云核医药(天津)有限公司(以下简称“云核医药”)自主研发的创新药物“INR101注射液”(受理号:CXHB2500257)正式获得临床试验默示许可。该药物为化学1类放射性诊断类创新药,拟用于前列腺癌患者中前列腺特异性膜抗原(PSMA)阳性病灶的正电子发射断层扫描(PET)成像,将为前列腺癌的精准诊断与病情评估提供全新技术支撑,标志着我国在核药诊断领域的研发取得重要突破。
01 关于云核医药

作为此次创新成果的研发主体,云核医药成立于2023年7月,是云南白药集团围绕国家医用同位素战略发展需求,结合北京大学核医学研究优势打造的创新药研发核心载体,承载着集团在精准诊疗核药领域的战略布局使命。公司落地天津后迅速推进研发基础设施建设,建成建筑面积超6000平米的研发基地,其中专门规划2000平米放射性工作场所,配备了研发热室、中试产线、小动物显像设备等先进设施,全面具备新药筛选、药物开发及临床样品生产供应能力。
2024年10月31日,云核医药顺利取得天津市生态环境局颁发的辐射安全许可证,正式具备使用放射性同位素和射线装置的资质,为放射性药品研发工作的开展奠定了关键基础。依托云南白药的资源优势与自身的专业研发能力,云核医药在核药领域快速崛起,此次INR101注射液的临床许可获批,正是公司研发实力的集中体现。
02 PSMA靶向成像,破解前列腺癌诊断难题
INR101注射液的核心价值在于其针对前列腺癌的精准靶向成像能力,这一特性与前列腺癌的临床诊断需求高度契合。前列腺特异性膜抗原(PSMA)是一种在前列腺癌细胞表面高表达的跨膜蛋白,其表达水平与肿瘤的恶性程度密切相关,已成为前列腺癌诊断与治疗的理想靶点。INR101注射液通过特异性结合PSMA,可在正电子发射断层扫描(PET)成像中清晰显示肿瘤病灶的位置、大小及分布情况,为临床诊断提供精准的影像学依据。
从临床应用场景来看,该药物将主要用于两大关键环节:一是前列腺癌根治治疗后疑似复发受试者的诊断,通过精准定位复发病灶,帮助医生及时调整治疗方案;二是前列腺癌患者术前盆腔淋巴结转移的评估,为手术方案制定提供重要参考。此前,INR101注射液已在国内登记两项多中心、开放、前瞻性的Ⅲ期临床试验,此次获得默示许可将进一步推动相关临床研究的开展。与传统诊断方式相比,INR101注射液的靶向成像技术具有灵敏度高、特异性强的优势,能够有效发现微小病灶,显著提升前列腺癌诊断的准确性。
03 赋能精准医疗,推动核药产业发展
INR101注射液获得临床试验默示许可,不仅对前列腺癌诊疗领域具有重要意义,更在产业发展与政策落地层面展现出多重价值。在临床层面,该药物的研发与应用将填补国内PSMA靶向PET成像诊断药物的市场空白,为广大前列腺癌患者提供更精准的诊断选择,有助于实现疾病的早发现、早治疗,降低患者死亡率,改善临床预后。
业内专家表示,随着INR101注射液临床试验的推进,有望加速其上市进程,为前列腺癌患者带来福音的同时,也将为我国核药产业的发展注入新动能,推动精准医疗理念在肿瘤诊疗领域的深度落地。