在核医学设备市场竞争加剧、硬件利润空间压缩的背景下,SPECT/CT设备面临临床需求提升与运营成本压力的双重挑战。当前,通过新型重建算法的软件革新正为这一传统核医学成像技术注入新的活力,使其在无需升级硬件的情况下实现成像性能的显著突破。
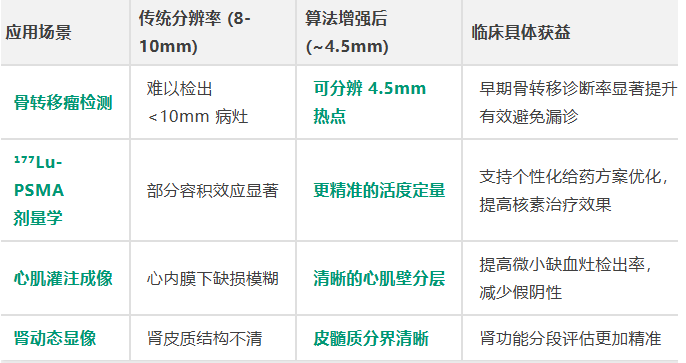
SPECT图像重建技术历经四代演进:从早期基于滤波反投影的线性解析算法,到引入泊松统计模型的迭代重建算法,再到加入正则化约束的统计优化方法,每一代进步都在不断逼近成像的物理极限。最新一代解剖结构引导重建技术通过融合CT图像提供的高分辨率解剖信息,作为重建过程的先验知识,成功将SPECT的空间分辨率提升至约4.5毫米,已接近PET的成像水平,同时实现了优异的噪声抑制与边界保持能力。
这一技术突破依赖于物理层、统计层与解剖层的三重协同建模:通过点扩散函数补偿初步恢复分辨率,利用正则化技术控制统计噪声,并最终借助解剖先验信息实现功能的精准空间定位。这意味着医疗机构无需更换探测器或准直器等昂贵硬件,仅通过软件升级即可大幅提升现有SPECT设备的成像质量与定量准确性。
在临床层面,4.5毫米的高分辨率成像为多种核医学应用带来了实质性提升:骨转移瘤的早期检出能力显著增强;¹⁷⁷Lu-PSMA等治疗核素的剂量学评估更为精准;心肌灌注成像中微小缺血灶的识别度提高;肾动态显像的皮髓质分界更加清晰。这些进步直接支持了精准诊断与个性化核素治疗的发展。
展望未来,人工智能技术将进一步推动SPECT技术的革新。基于深度学习的合成CT技术有望降低对硬件CT的依赖,促进核医学在基层医疗的普及;智能重建算法则可实现扫描参数的自适应优化,持续提升图像质量与定量稳定性。
当前,算法创新已成为核医学成像发展的核心驱动力。在硬件发展面临瓶颈的行业环境下,通过软件赋能挖掘现有设备潜力,不仅是应对市场挑战的战略选择,更是推动SPECT技术持续满足精准医疗需求的关键路径。